- RiffReporter /
- Wissen /
Hilfe durch Gentherapie mit Crispr/Cas – wenn Medikamente das gestörte Erbgut verändern
Hilfe durch Gentherapie – wenn Medikamente das gestörte Erbgut verändern
Die Genschere Crispr/Cas wurde 2012 entdeckt. Schon elf Jahre später erhält Casgevy als gentechnisches Medikament gegen Bluterkrankungen die offizielle Zulassung. Nach einer einmaligen Behandlung sind viele Betroffene geheilt. Die neue Therapie mit einem Eingriff in die DNA weckt Ängste und Hoffnung zugleich.
Die Nachricht zum Ende des Jahres ist eine kleine Sensation und eine große Hoffnung zugleich. In Großbritannien, den USA und in Europa wurde die erste echte Gentherapie offiziell für die Anwendung in spezialisierten Krankenhäusern zugelassen. 2023 wird als das Jahr in die Geschichte eingehen, in dem die Veränderung von Genen als neues Therapieverfahren den Schritt von der klinischen Forschung in den medizinischen Alltag vollzogen hat.
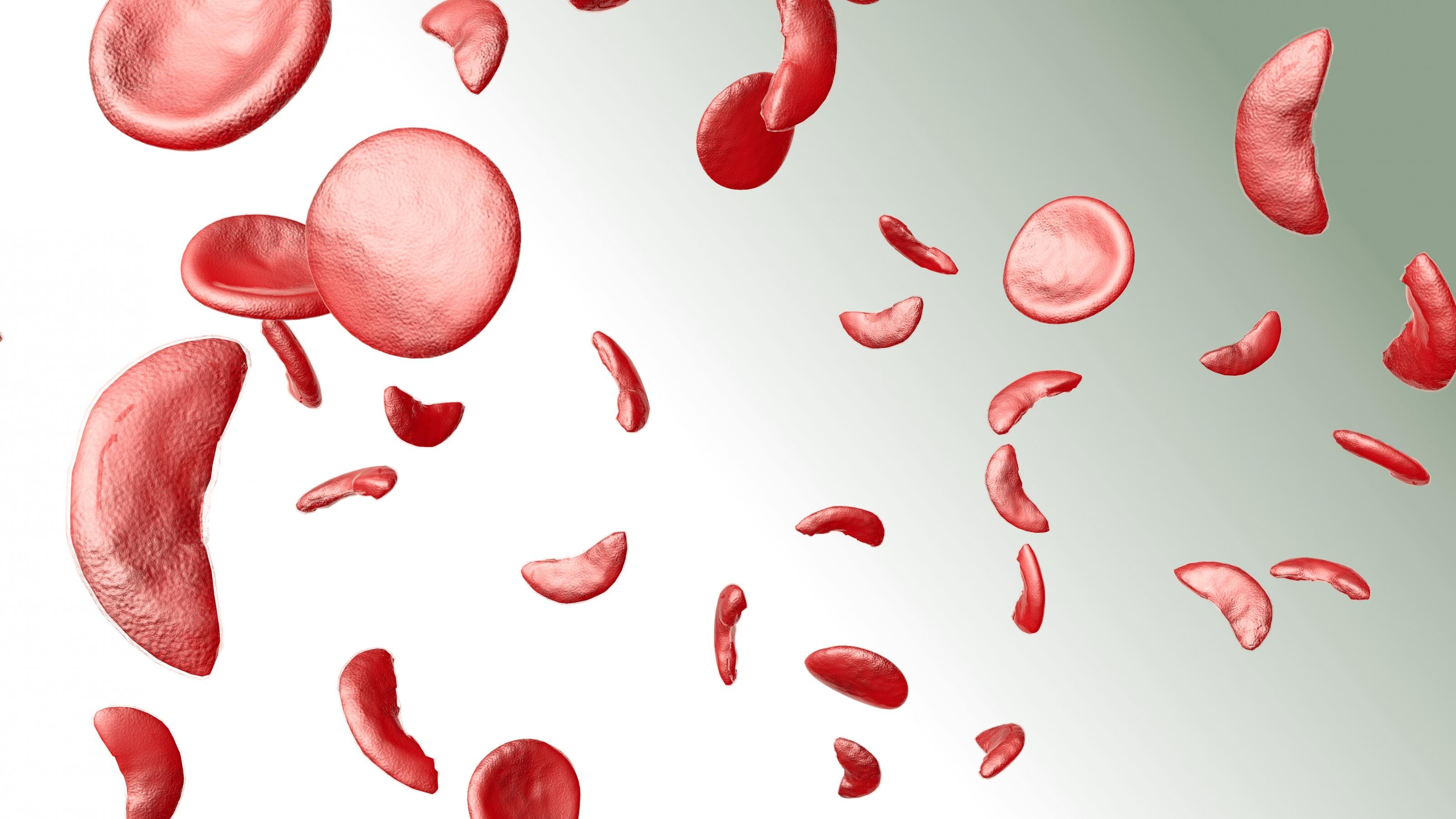
Die ersten PatientInnen, die davon profitieren, sind Menschen mit lebensbedrohlichen Bluterkrankungen. Die neue Therapie namens „Casgevy“ war bei der Sichelzellenanämie und der Beta-Thalassämie erfolgreich. Beide Erkrankungen unterscheiden sich in den Ausprägungen, aber sie teilen eine Gemeinsamkeit: Die Betroffenen leiden unter Gendefekten. Ihr Körper produziert zu wenig gesunde rote Blutkörperchen, weil deren zentraler Bestandteil, das Hämoglobin, einen Fehler aufweist. Die Mutationen haben schwere Auswirkungen, denn die Zellen des Körpers werden nur schlecht mit Sauerstoff versorgt. Bei der Sichelzellenanämie ist das Hämoglobin zudem noch stark verformt, das führt zu Schmerzattacken und Organschäden durch verstopfte Blutgefäße.
Crispr/Cas aktiviert fetales Hämoglobin
Bisher konnten die Beschwerden der PatientInnen nur mit regelmäßigen Bluttransfusionen gelindert werden. Eine Heilung war nicht möglich. Das hat sich Dank eines neuen Werkzeugs der Biotechnologie geändert. Die TherapeutInnen können mit der Genschere Crispr/Cas die Blockade eines anderen Wegs der Hämoglobin-Produktion aufheben. Crispr/Cas reaktiviert einen Prozess, der ursprünglich nur zur Sauerstoffversorgung im Embryo vorgesehen ist und wenige Tage nach der Geburt ausgeschaltet wird. Durch den Eingriff produzieren die PatientInnen wie der Embryo im Mutterleib fetales Hämoglobin, das die defekten roten Blutkörperchen ersetzt.
Die US-Amerikanerin Victoria Gray wurde im Juli 2019 als erste Sichelzellen-Patientin mit der neuen Therapie behandelt. Sie benötigt seitdem keine Transfusionen mehr. Von den etwa 100 Menschen, die bisher weltweit an klinischen Studien teilgenommen haben, gelten mindestens 67 als geheilt. Ein überwältigendes Ergebnis. In 30 weiteren Fällen liegt die Therapie noch nicht lange genug zurück, als dass die Auswirkungen abschließend bewertet werden können.
Nur sieben Jahre bis zum ersten Test
Die Heilung ist schon ein großer Erfolg. Aber das neue Therapiekonzept mit gezielten Veränderungen im Genom hat weitere Vorteile. Es verringert deutlich die Zeitspannen, die bisher für die Entwicklung von Medikamenten galten. Nach Angaben des Verbands der forschenden Pharma-Unternehmen (VfA) dauert es im Schnitt 13 Jahre, bis ein neues Medikament die PatientInnen erreicht. Anders bei der Gentherapie. Die Genschere Crispr/Cas ist erst 2012 entdeckt worden. Für die Anwendung in der Medizin war viel Grundlagenforschung nötig. Doch schon sieben Jahre später wurde das Werkzeug am Menschen für medizinische Zwecke getestet. „Damit es so schnell gehen konnte, musste vieles perfekt ineinandergreifen: technologischer Fortschritt, wissenschaftlicher Forscherdrang und viel Geld von Unternehmen“, erklärte Crispr-Entdeckerin Jennifer Doudna in einem Interview. Das sei wahnsinnig aufregend, einfach fantastisch, so die Nobelpreisträgerin von 2020.
DNA-Analytik und Genschere verändern Forschung
Crispr/Cas ist die zweite bahnbrechende Veränderung der Gentechnik in diesem Jahrtausend. Der erste große Schritt lag in der Automatisierung der DNA-Analytik. Heute kann das Erbgut von Pflanzen, Tieren und Menschen binnen weniger Tage komplett analysiert werden. Weltweit wächst das Wissen um die Bedeutung einzelner Gene, und so werden auch immer mehr Fehler in der DNA identifiziert. Im Mai dieses Jahres wurde das Pangenom des Menschen vorgestellt. Der Datensatz basiert nicht mehr auf einer Person, er verknüpft das Genom von 47 Individuen unterschiedlicher Herkunft. Damit spiegelt er die Varianten innerhalb der Menschheit besser wieder als das alte Referenzgenom, das im wesentlichen nur von einer Person stammte.
Mit Crispr/Cas haben die Forschenden jetzt ein Werkzeug, das schnell, billig und einfach in der Handhabung ist. Internationale Datenbanken im Internet erleichtern den Kauf und die Auswahl der benötigten DNA-Fragmente sowie der übrigen Materialien. So ist Crisp/Cas mittlerweile das am weitesten verbreitete Verfahren für neue Therapieansätze bei Krankheiten, die aufgrund von genetischen Defekten entstehen.
Einsatz bei Volkskrankheiten beschränkt
Diese Einschränkung ist wichtig, denn die Genschere ist kein Wundermittel gegen jede Erkrankung. Ihr Einsatz ist dann besonders aussichtsreich, wenn die Ursache der Krankheit möglichst eindeutig mit sehr wenigen oder nur einem Gen zusammenhängt. Auf viele der weit verbreiteten Volkskrankheiten trifft das nicht zu: Bei ihnen sorgen Veränderungen in einer großen Gruppe von Genen für ein erhöhtes Krankheitsrisiko. Crispr/Cas eignet sich hier nur begrenzt zur Therapie, es kann nicht mehrere Gene gleichzeitig reparieren. Zudem darf nicht vergessen werden, dass viele Krankheiten vor allem durch unseren Lebenswandel begünstigt werden: Rauchen, Alkohol, zu wenig Bewegung, schlechte Ernährung und vieles mehr.
Doch wenn die Wissenschaft erst einmal ein mögliches Ziel für den Einsatz der Gentechnik in der Therapie identifiziert hat, kann alles sehr schnell gehen. Das haben die Biotechnologiefirmen Moderna und Biontech bei der Entwicklung
der Corona-Impfstoffe gezeigt. Biontech-Chef Uğur Şahin sagt, es handele sich „um die schnellste Impfstoffentwicklung in der Geschichte der Medizin“.
Nobelpreis für Crispr- und mRNA-Technologie
Die Impfstoffhersteller haben zwar nicht mit Crispr/Cas gearbeitet, aber ihr Ansatz über mRNA-Technologie nutzt ebenfalls das wachsende Wissen um die Bedeutung von Genen, DNA- und RNA-Fragmenten für die Produktion von Proteinen und anderen Hilfsstoffen im menschlichen Körper. Für die mRNA-Technologie wurden Katalin Karikó und Drew Weissman im Jahr 2023 mit dem Medizin-Nobelpreis ausgezeichnet. Zwei Preise binnen vier Jahren: Ein Zeichen, welche Bedeutung das Nobelkomitee der Gentechnik bemisst. Die Dynamik in Forschungsgebiet der mRNA ist ähnlich gewaltig wie bei Crispr/Cas. Die bahnbrechenden Arbeiten der Nobelpreisträger wurden erst 2009 veröffentlicht, und schon 15 Jahre später existiert eine milliardenschwere Branche, die in klinischen Studien erstaunliche Erfolge erzielt.
Das Tempo der Entwicklung wird sich in den kommenden Jahren weiter beschleunigen, vermutet Fyodor Urnov, einer der Pioniere der Genveränderung am Menschen. Urnov arbeitet heute als Direktor des Innovative Genomics Instituts (IGI) in Kalifornien, einem Zusammenschluss von Universitätsforschung, großen Pharma-Unternehmen und mehreren Start-ups, die sich jeweils speziellen Fragestellungen im Bereich der Gentherapie widmen. Urnov nennt als Beispiel die US-Firma Intellia, die genetisch bedingte Erkrankungen der Leber behandeln will. Sie hat eine Methode entwickelt, mit der die Genschere Crispr/Cas offenbar zuverlässig in die Leber transportiert wird, damit sie dort ihre Arbeit erledigen kann.
Schnelle Entwicklung durch Baukastensystem
Als erste Erkrankung haben die Forschenden die tödliche hATTR-Amyloidose ausgewählt, bei der Leber-Proteine falsch gefaltet werden und dadurch verklumpen. Die falsch gebildeten Proteine lagern sich in anderen Organen ab und schädigen sie dadurch. Als diese Therapie erste Erfolge zeigte, haben die Entwickler unmittelbar eine andere in der Leber entstehende Krankheit, das Angioödem, einbezogen. „Intellia verwendet dabei viele vorhandene Bausteine: es sind dieselben Lipid-Nanopartikel, dieselbe Cas9-mRNA und dieselbe Methode zur Verabreichung der Einzeldosis-Infusion“, erklärt Urnov das Konzept. Der Aufwand für die Anpassung an eine andere genetische Krankheit sei deshalb gering gewesen. „Sie haben nur 20 Nukleotide der guide-RNA verändert und erhielten dadurch ein Medikament für eine andere Krankheit“, erklärt Fyodor Urnov. Damit sei bewiesen, dass CRISPR als therapeutische Plattformtechnologie in der Klinik eingesetzt werden könne.
Intellia ist eng mit IGI verbunden, bei seinem Lob ist daher Vorsicht geboten. Aber andere Beobachter kommen zu einem ähnlichen Schluss, falls sich die bisher nicht veröffentlichten Intellia-Daten als korrekt erweisen.
Gentherapie verändert Pharmabranche
Die neue Form der Gentherapie wird große Bereiche der Pharmabranche revolutionieren. Sie kann sogar etablierte Geschäftsmodelle zerstören. Denn bisher haben sich viele Pharmaunternehmen darauf konzentriert, Medikamente zu entwickeln, die die PatientInnen jahrzehntelang einnehmen. Eine Gentherapie soll aber nur einmal angewendet werden, weil sie die Ursache der Erkrankung behebt.
Gefragt ist also nicht mehr die Produktion von Medikamenten in großen Mengen. Nötig sind Zelllabore, in denen BiotechnologInnen arbeiten, die mit Crispr/Cas die Gene in den Zellen der PatientInnen verändern. Universitätskliniken könnten diese Spezialisten sogar in eigenen Laboren beschäftigen. Diese Einrichtungen ließen sich gleichzeitig für moderne Therapien mit Stammzellen verwenden, deren klinische Anwendung ebenfalls bevorsteht.
Bei „Casgevy“ als Therapie für die Sichelzellenanämie und die Beta-Thalassämie wird dieses Prinzip schon angewandt. Die ÄrztInnen entnehmen den PatientInnen blutbildende Stammzellen und versetzen diese im Labor mit dem Crispr/Cas-Gemisch. Die im Körper verbliebenen erkrankten Stammzellen werden mit einer Chemotherapie abgetötet. Danach geben die MedizinerInnen die reparierten Zellen zurück in den Körper, wo sie fortan gesundes Blut produzieren.
Therapie kostet mehr als eine Million Euro
Allerdings ist diese Behandlung noch sehr aufwändig und teuer. Die einmalige Therapie mit der jetzt zugelassenen
Genschere „Casgevy“ wird vermutlich ein bis zwei Millionen Euro kosten. Dafür spart das Gesundheitssystem die Kosten für jahrzehntelange Bluttransfusionen. Doch schon jetzt ist absehbar, dass die Therapie nicht alle Betroffenen erreichen
wird. Die Beta-Thalassämie ist beispielsweise in der Mittelmeerregion, dem Nahen und Mittleren Osten, weiten Teilen Asiens und in Afrika verbreitet. Dort fehlen häufig nicht nur die Strukturen an den Krankenhäusern, sondern auch das
Geld für eine Behandlung. In Deutschland leben etwa 500 Menschen mit dieser Krankheit. Nun beginnt die Diskussion, ob „Casgevy“ als Kassenleistung allen Versicherten zustehen soll. Für die Krankenkassen könnten rasch Kosten von mehr als 100 Millionen Euro entstehen.
Gentherapie gegen starke Schmerzen
Auch das ist ein Grund, warum nicht alle Experten die Therapien mit der Genschere Crispr/Cas als Durchbruch in der medizinischen Versorgung bewerten. Doch in kaum einen anderen Bereich werden so große Hoffnungen gesetzt. Es gibt Versuche, bei PatientInnen mit starken, dauerhaften Schmerzen die Schmerzübertragung genetisch auszuschalten und ihnen nicht nur ein Leben ohne Medikamente zu ermöglichen, sondern sie auch von den Nebenwirkungen der starken Opiate zu befreien. Eltern von Kindern mit starken Entwicklungsstörungen im Muskel- oder Knochenaufbau hoffen, dass ein frühzeitiger Eingriff in die Gene ihrem Nachwuchs ein normales Aufwachsen ermöglicht.
Für diese Betroffenen ist die Meldung von der Zulassung von „Casgevy“ ein Hoffnungsschimmer – aber auch nicht mehr. „Casgevy“ funktioniert so zuverlässig dank der Veränderung von wenigen Zellen außerhalb des menschlichen Körpers. Wenn die Genschere dagegen intravenös in den Blutkreislauf gegeben werden wird und sich dort erst ihr Ziel suchen muss, steigt die Wahrscheinlichkeit, dass es zu Genveränderungen an falschen Stellen oder in falschen Zellen kommt. Die Forschenden sind zuversichtlich, dass sie dieses Problem lösen können. Sie koppeln Crispr/Cas beispielsweise mit einer Genfähre, die verschiedene Zelltypen auseinanderhalten kann.
Crispr/Cas braucht noch Geduld
Ob diese Konzepte Erfolg haben, wird sich erst in ein paar Jahren zeigen. Wahrscheinlich wird es Rückschläge geben. Aber der Optimismus der EntwicklerInnen scheint unerschütterlich. „Die Crispr-Technologie verändert grundsätzlich, wie wir über Medizin denken“, sagt Jennifer Doudna. Sie meint damit, dass nicht mehr Symptome therapiert werden, sondern direkt die Ursachen von Krankheiten behoben werden. Die Nobelpreisträgerin hat genau wie ihre Kollegin Emmanuelle Charpentier,
ebenfalls mit dem Nobelpreis ausgezeichnet, deshalb schon früh Firmen gegründet, die Gentherapien entwickeln.