Neues aus der Epigenetik: Wie man Schizophrenie im Blut erkennt
Außerdem: Einzelzell-Epigenomik erklärt, wie sich das Großhirn entwickelt und Systembiologie erkundet, was bei Alzheimer und Demenz passiert.
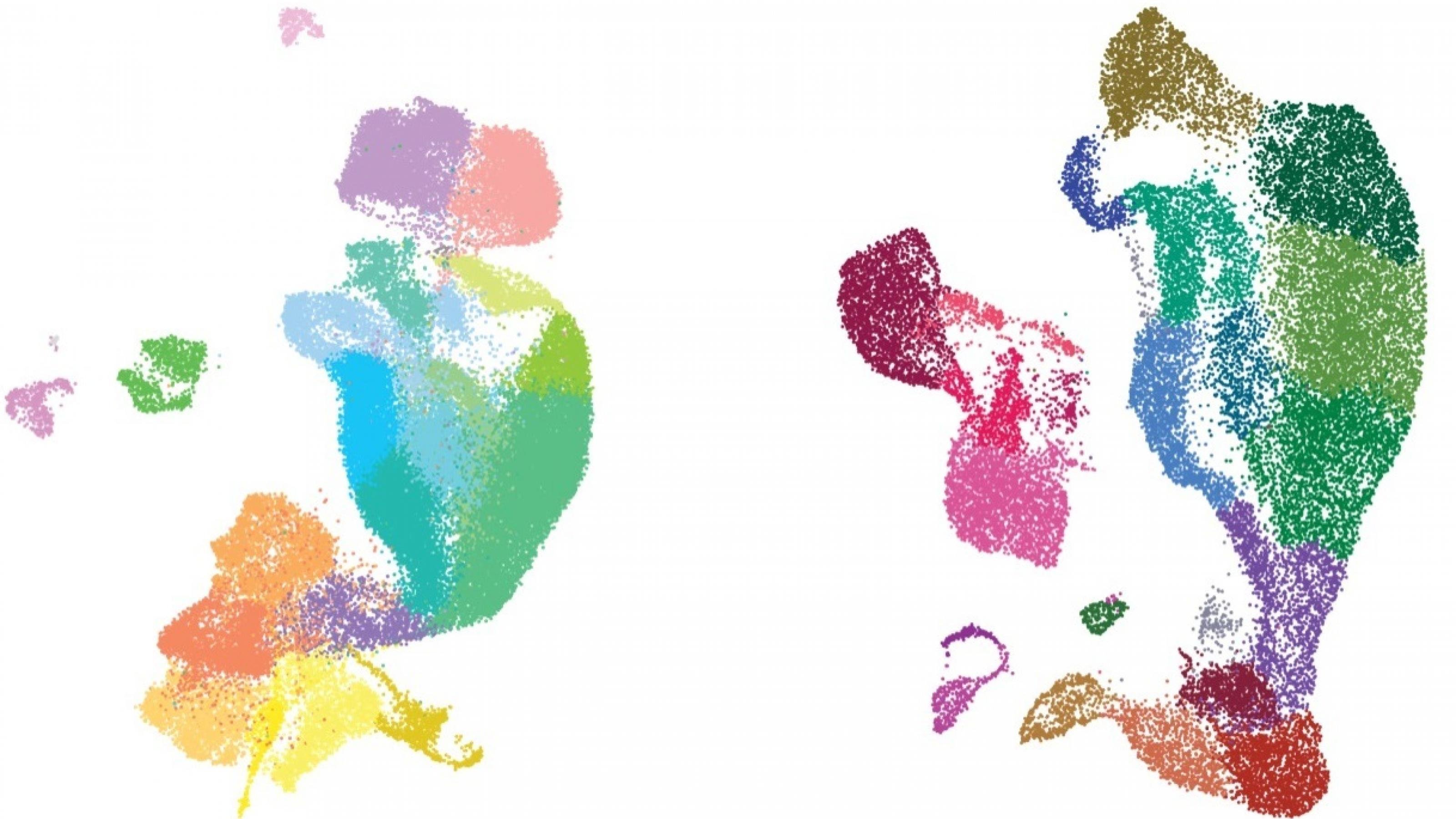
Das neueste aus der Epigenetik: Mit Einzelzell-Analysen spürten Forscher*innen der Frage nach, wie sich das menschliche Großhirn aus wenigen Zellen heraus entwickelt. Ein anderes Team fand mit Künstlicher Intelligenz epigenetische Markierungen im Blut, mit deren Hilfe man eine Schizophrenie erkennen kann. Und mehrere neue Studien zu Alzheimer und Demenz helfen uns nicht nur, die Altersleiden auf systemischer Ebene zu verstehen, sie lassen uns sogar auf neue Methoden der Früherkennung und Behandlung hoffen.
Schizophrenie im Blut erkennen
Schizophrenie ist ein komplexes psychisches Leiden, dessen Ursachen noch immer weitgehend unbekannt sind. Es gibt Hinweise, dass genetische Variationen und Umweltfaktoren das Risiko gemeinsam beeinflussen. Da liegt es nahe, im Epigenom Betroffener nach Auffälligkeiten zu suchen, die vielleicht sogar für eine Abschätzung des Schizophrenie-Risikos von Menschen geeignet sind. Bisherige Ansätze waren indes wenig erfolgreich. Jetzt scheint der bekannte Epigenetiker Robert Waterland vom Baylor College of Medicine, USA, mit seinem Team aber eine heiße Spur gefunden zu haben.
Die Forscher*innen nutzten dabei eine Methode der so genannten Künstlichen Intelligenz. Sie trainierten einen Algorithmus des maschinellen Lernens darauf, verborgene Muster in mehr als 800 epigenomischen Analysen von Blutproben von Menschen mit und ohne Schizophrenie auseinanderzuhalten. Fündig wurden sie bei einer Untergruppe von Methylierungen an der DNA, die besonders früh im Laufe des Lebens entstehen und deshalb bei Zellen des Gehirns und Bluts gleich sein dürften. Nach dem Training war der Computer in der Lage, die Erkrankung bei vier von fünf schizophrenen Menschen anhand der Blutprobe zu erkennen. Damit war das Ergebnis besser, als Verfahren, die ausschließlich den DNA-Text auswerten. Auch den Vorwurf, man messe lediglich Folgen der Schizophrenie, wie etwa epigenetische Veränderungen durch Medikamente oder einen hohen Zigarettenkonsum, nicht deren mögliche Ursachen, entkräfteten die Forscher*innen: „Wir haben mit verschiedenen Ansätzen ausgewertet, ob die von uns festgestellten Methylierungsmuster durch Medikamenteneinnahme und Rauchen beeinflusst werden. Beides konnten wir ausschließen“, sagt Waterland.
Einzelzell-Epigenomik: Wie die Großhirnrinde sich entwickelt
Ein Forscherteam aus Stanford, USA, an dem auch der Bioinformatiker Fabian Müller von der Universität des Saarlandesbeteiligt war, hat eine bemerkenswerte systembiologische Analyse der biologischen Entwicklung der menschlichen Großhirnrinde vorgelegt. Das Team wertete mit Hilfe der Einzelzellbiologie Gewebeproben aus der Zeit zwischen der 16. und 24. Woche nach der Befruchtung aus. Insgesamt wurde von fast 58.000 Zellen registriert, welche Gene sie gerade in Proteine übersetzen (Transkriptomik). Bei 31.300 Zellen gelang Müller und Kolleg*innen zudem die epigenomische Einzelzell-Analyse mit der ATAC-seq-Methode. Sie ermittelt, welche Abschnitte der DNA in der ausgewerteten Zelle zu einem bestimmten Zeitpunkt aufgrund ihres epigenetischen Zustands besonders leicht zugänglich für die Gen-Ablesemaschinerie sind (siehe Newsletter Epigenetik 32, 12/2019: Offenes Chromatin lesen).
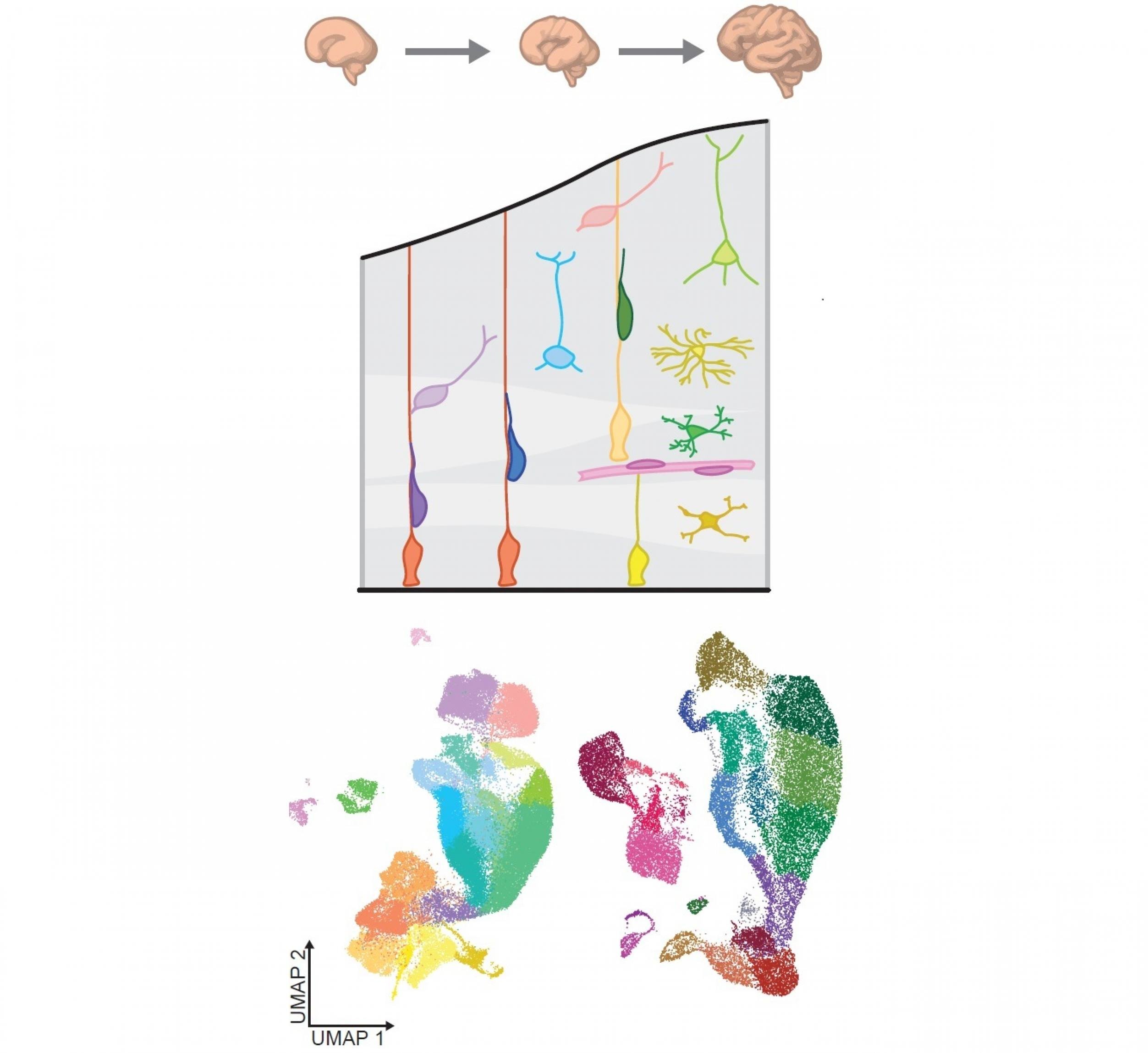
Heraus kam ein Atlas, der akribisch nachzeichnet, wie sich die vielen verschiedenen Zelltypen der wichtigen Gehirnregion aus bestimmten Vorläuferzellen heraus entwickeln. Demnach scheint es zunächst die Epigenetik zu sein, die das Schicksal der Zellen festlegt. Indem sie den Chromatin genannten Komplex aus DNA und angelagerten Histonproteinen an manchen Stellen auflockert, macht die Nebengenetik verschiedene DNA-Regionen zugänglich für Botenstoffe (Transkriptionsfaktoren). Diese können dann an ganze Gruppen von Elementen binden, die die Aktivität benachbarter Gene verstärken oder abschwächen (Enhancer oder Silencer). Das daraus resultierende spezifische Genaktivitätsmuster setzt dann die gezielte Differenzierung der jeweiligen Zelle in die Tat um.
Schließlich berechneten die Forscher*innen, welches Netzwerk die miteinander verbundenen Gene und Genregulations-Elemente miteinander knüpfen. Und in einem letzten Schritt nutzten sie einen Deep-Learning-Algorithmus, also ein auf virtuellen neuronalen Netzen basierendes Verfahren, um dieses Netzwerk mit einer Datenbank zu vergleichen, die genetische Veränderungen bei Menschen mit Autismus oder verwandten Beeinträchtigungen der Gehirnentwicklung sammelt. Dieser systembiologische Einsatz einer so genannten Künstlichen Intelligenz spürte wichtige Beziehungen auf, die mit herkömmlichen Methoden unsichtbar geblieben waren. So entdeckten die Forscher*innen einige DNA-Veränderungen, die zwar jenseits der eigenetlichen Gene liegen, aber dennoch die Wahrscheinlichkeit von Autismus und verwandten Beeinträchtigungen erhöhen dürften, weil sie die Regulation wichtiger Gene verändern.
Alzheimer und Demenz systemisch verstehen
Um komplexe Krankheiten zu verstehen, früh zu erkennen und effektiv zu behandeln, versucht die Wissenschaft zunehmend, das Leben systembiologisch zu betrachten. Diese Disziplin erforscht die zahlreichen beteiligten biologischen Komponenten und ihr Beziehungsnetzwerk sowie den Effekt äußerer Einflüsse. Wie wichtig dabei Informationen über die Epigenetik der Zellen sind, unterstreichen jetzt drei völlig unterschiedliche Studien, die alle das gleiche Objekt betrachten: die Alzheimer’sche Krankheit und das Auftreten von Demenz.
Ein internationales Team um Rebecca Smith und Katie Lunnon von der University of Exeter, Großbritannien, wertete große Mengen von Daten aus mehreren früheren Studien zur Epigenomik (systematische Auswertung epigenetischer Markierungen) von Alzheimer aus, über die teilweise auch im Newsletter Epigenetik berichtet wurde (03/2014: Das Alzheimer-Epigenom; 11/2018: Es gibt zwei Alzheimer-Epigenome). Insgesamt verrechnete das Team für diese Meta-Analyse Informationen zum Methylierungsmuster an der DNA von 1.408 Personen. Anschließend gelang sogar der Beleg, dass die Befunde auch auf mehr als 600 weitere Personen zutreffen. So wurden einige neue Stellen im Erbgut der Gehirnzellen entdeckt, die bei Betroffenen systematisch epigenetisch verändert zu sein scheinen. Sogar die Regulation von Genen ist betroffen, die bislang noch nicht mit Alzheimer assoziiert wurden. Außerdem gelang der Nachweis, dass das rätselhafte Degenerationsleiden, das etwa 60 Prozent aller Fälle von Altersdemenz verantwortet, nur Zellen der Großhirnrinde aber nicht des Kleinhirns betrifft.
Was der Meta-Analyse allerdings fehlt, ist die parallele Auswertung, inwieweit die epigenetischen Auffälligkeiten auch tatsächlich die Aktivität einzelner Gene verändert und welche Art von Zellen wie stark zum Gesamtgeschehen beiträgt. Dazu benötigt es die Kombination der Epigenomik mit der so genannten Transkriptomik, die misst, welche Gene abgelesen werden – und das auch noch auf der Ebene einzelner Zellen, nicht etwa in Gemischen, die viele verschiedene Zellen zugleich enthalten. An exakt diese Kombination wagten sich jetzt der Systembiologe Samuel Morabito von der University of California in Irvine, USA, und Kolleg*innen.
Ihre gleichzeitige Analyse der epigenetisch regulierten Zugänglichkeit der DNA und der Transkriptomik innerhalb einzelner Zellen von Alzheimer-Patient*innen sei „eine wertvolle Ressource für das Verständnis regulatorischer Zusammenhänge im erkrankten Gehirn“, schreiben die Autor*innen. Tatsächlich eröffnet der Blick weg von einzelnen Symptomen des erkrankten Organs auf das ganzheitliche systemische Beziehungsgeflecht, das seine hochkomplexen Eigenschaften ausmacht, völlig neue Einsichten. Unter Anderem wurde auch hier ein Gen entdeckt, dessen Produkt sich als Ansatzpunkt für zukünftige Anti-Alzheimer-Therapien eignet.
Um einen neuen, vielversprechenden Ansatz zur Früherkennung einer Altersdemenz geht es in der dritten Studie. Das Team um André Fischer und Rezaul Islam vom Deutschen Zentrum für Neurodegenerative Erkrankungen (DZNE) in Göttingen nutzte eine Kombination aus Laboruntersuchungen und menschlichen Daten, um epigenetische Botenstoffe im Blut aufzuspüren, die schon dann besonders zahlreich im Blut zirkulieren, wenn eine kurz bevorstehende Demenz noch gar nicht ausgebrochen ist. Es handelt sich um drei so genannte Mikro-RNAs (miR-181a-5p, miR-148–3p, miR-146a-5p), die die Übersetzung zu ihnen passender Gene in Proteine behindern.
Noch müsse überprüft werden, ob die drei Stoffe tatsächlich zuverlässig genug das Auftreten einer Demenz ankündigen können, sagt Fischer. Außerdem sei die Messung für eine flächendeckende Anwendung zu aufwändig. Aber er ist optimistisch, diese Probleme noch zu lösen: „Wir schätzen, dass dieser Biomarker beim Menschen eine Entwicklung andeutet, die etwa zwei bis fünf Jahre in der Zukunft liegt.“ Doch damit nicht genug: Erste Tierversuche legen nahe, dass die Mikro-RNAs die Demenz aktiv beschleunigen und sich der drohende Gedächtnisverlust durch eine Blockade der epigenetischen Substanzen in Zukunft vielleicht bremsen ließe.
***
Diese Meldungen wurden zuerst imNewsletter Epigenetik 35 publiziert. Der Newsletter Epigenetikerscheint bis zu vier Mal pro Jahr und ist kostenfrei. Exklusive Hintergrund-Beiträge zu ausgewählten Themen erscheinen vorab bei Riffreporter Erbe&Umwelt. Finden Sie hier eine Übersicht über alle auf Erbe&Umwelt erschienenen Epigenetik-Meldungen.