- RiffReporter /
- Wissen /
Vererbtes Depressionsrisiko, Stammzell-Vesikel fürs Herz und mehr Bewegung für Schwangere
Vererbtes Depressionsrisiko, Stammzell-Vesikel fürs Herz und mehr Bewegung für Schwangere
Der Newsletter Epigenetik 34 ist erschienen
Drei ausgewählte Meldungen aus der aktuellen Ausgabe: Wie Mäuse ihr Depressionsrisiko epigenetisch vererben, Stammzell-Vesikel Herzen reparieren und Bewegung in der Schwangerschaft möglicherweise Kinder schützt.
Die 34. Ausgabe des Newsletter Epigenetik ist erschienen. Dieser unabhängige Newsletter fasst seit 2010 die wichtigsten Neuigkeiten aus einem der spannendsten Forschungsgebiete unsere Zeit zusammen. Alle vollständigen Ausgaben sowie ein Archiv mit den bisher erschienenen Beiträgen finden Sie auf den Online-Seiten des Newsletter Epigenetik.
Sie können das kostenfreie Angebot unterstützen –mit einem Erbe&Umwelt-Abo. Dann erhalten Sie auch den Zugang zu vielen kostenpflichtigen Hintergrundbeiträgen.
An dieser Stelle veröffentliche ich wie immer Titelbild, Inhaltsverzeichnis und drei ausgewählte Meldungen des neuen Newsletter Epigenetik.

Epigenetische Vererbung des Depressionsrisikos
Depressionen treten oft in Familien gehäuft auf, obwohl bislang nur ein vergleichsweise kleiner Teil des Risikos auf genetische Unterschiede zurückzuführen ist. Deshalb gerät die epigenetische Vererbung zunehmend in den Fokus. Vor allem Experimente mit Mäusen haben vielfach ergeben, dass sich depressionsähnliche Symptome auch epigenetisch von Vätern auf Nachkommen übertragen. Das geschieht sogar dann, wenn die Muttertiere vollkommen gesund sind und die Nachkommen per künstlicher Befruchtung gezeugt werden. Der Newsletter Epigenetik berichtete zuletzt in Ausgabe 30 darüber (Epigenetische Vererbung über vier Generationen).
Nun liefern chinesische Forscher*innen spannende neue Details. Yanbo Wang und Kolleg*innen setzten ausgewachsene männliche Mäuse längere Zeit unter Stress, so dass sie Symptome eines Zustands zeigten, der an menschliche Depressionen erinnert. Die Kinder dieser Tiere waren auf den ersten Blick normal. Aber sie reagierten auch als ausgewachsene Tiere besonders empfindlich auf Stress und zeigten dann die Symptome ihrer Väter. Eine Gruppe mit gewöhnlichen Vätern und auch die Enkel der ursprünglich gestressten Tiere waren hingegen widerstandsfähiger.
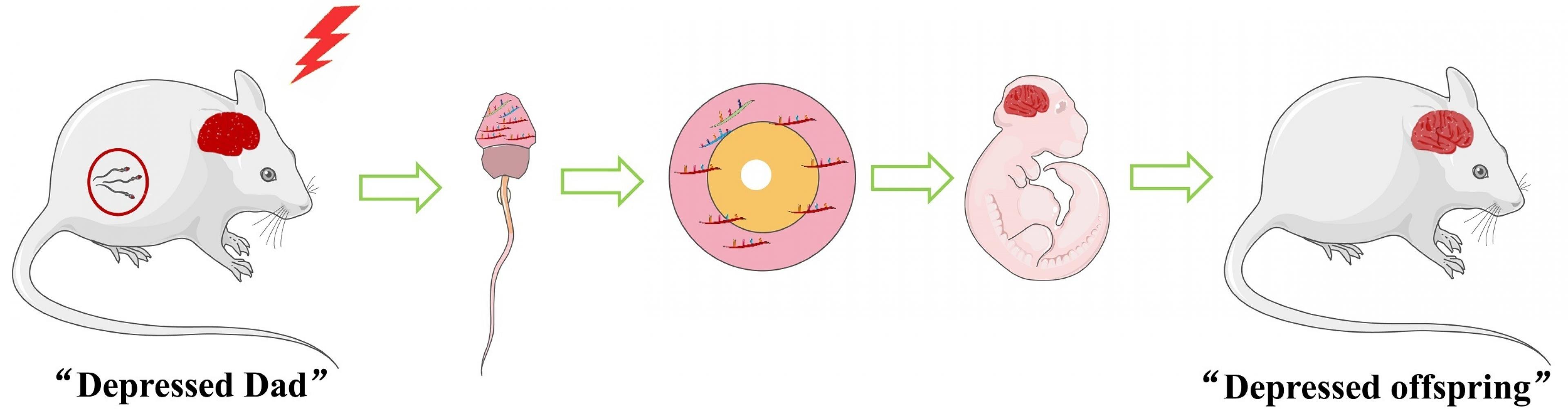
Nun suchten die Forscher*innen nach möglichen Überträgern des Depressionsrisikos. Fündig wurden sie bei Mikro-RNAs in den Spermien. Diese epigenetisch aktiven Substanzen können per RNA-Interferenz die Genregulation und damit die Entwicklung wenige Tage alter Nachkommen beeinflussen. Und tatsächlich kreisten Wang und Kolleg*innen einige, für das Nervensystem wichtige Gene ein, die wegen der Mikro-RNAs aus den Spermien der Väter seltener in Proteine übersetzt wurden. Mit künstlichen Anti-Mikro-RNAs, die diesen Effekt verhinderten, unterbanden die Forscher*innen die epigenetische Weitergabe. Umgekehrt konnten sie den Effekt auch durch die Zugabe künstlicher Mikro-RNAs in frisch gezeugte Nachkommen mit zwei gesunden Eltern auslösen. Zumindest über eine Generation hinweg geben Mäuse ihre Depressionsneigung also epigenetisch weiter.
Mikro-RNA lässt neue Herzgefäße sprießen
Schon lange hofft die Medizin darauf, geschädigte Herzen von Infarktpatient*innen mit Stammzellen zu kurieren. Die besonderen Zellen, die sich zu den verschiedensten Geweben weiterentwickeln können, sollen abgestorbene Muskeln und Herzkranzgefäße ersetzen oder deren Wachstum anregen. Da die meisten implantierten Stammzellen aber rasch sterben, blieb der Erfolg dieses Ansatzes bislang aus. Deshalb versuchen Kardiolog*innen längst etwas Neues: Sie pflanzen keine Zellen mehr ein, sondern geben in die Herzen so genannte extrazelluläre Vesikel, die im Labor von Stammzellen erzeugt wurden. Diese enthalten einen regelrechten Cocktail an Botenstoffen, darunter auch solche, die epigenetisch aktiv sind.
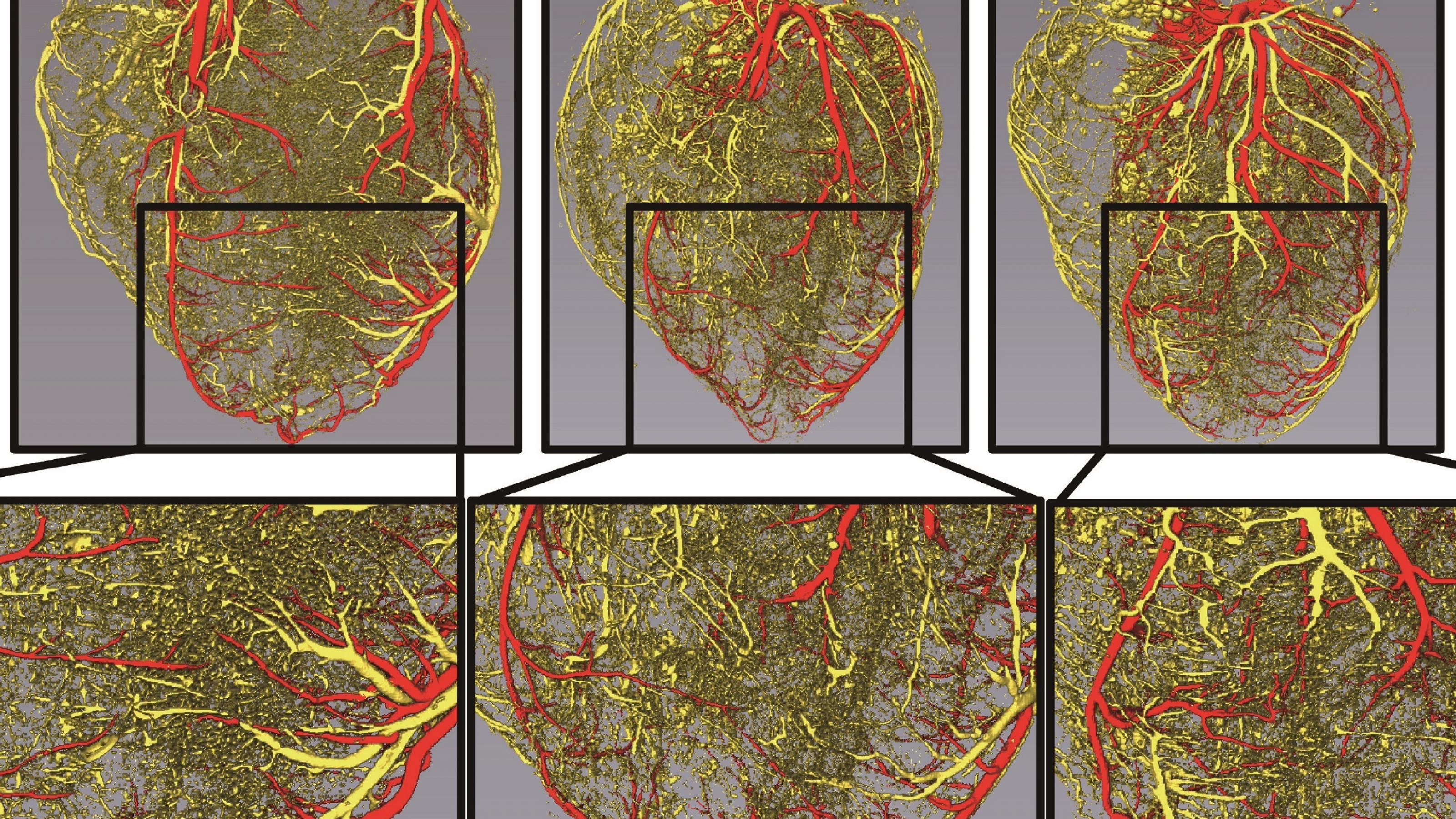
Nun erzielten Forscher*innen aus China und den USA mit der neuen Methode erstaunliche Erfolge. Qingju Li und Kolleg*innen gelang es nicht nur, mit Hilfe der Vesikel bei Mäusen und Makaken Herzkranzgefäße nach einem Herzinfarkt nachwachsen zu lassen. Sie zeigten auch, welcher der Botenstoffe für einen Großteil des Effekts verantwortlich zu sein scheint. Es handelt sich um die Mikro-RNA miR-486–5p. Diese epigenetisch aktive Substanz verhindert per RNA-Interferenz, dass der Code eines Gens namens Mmp19 in das zugehörige Protein übersetzt wird. Da dieses Protein wiederum den Wachstumsfaktor zersetzt, der neue Blutgefäße sprießen lässt, sorgt die Mikro-RNA dafür, dass das normalerweise vom MmP19–Protein unterdrückte Wachstum anspringen kann und das geschädigten Herz sich regeneriert.
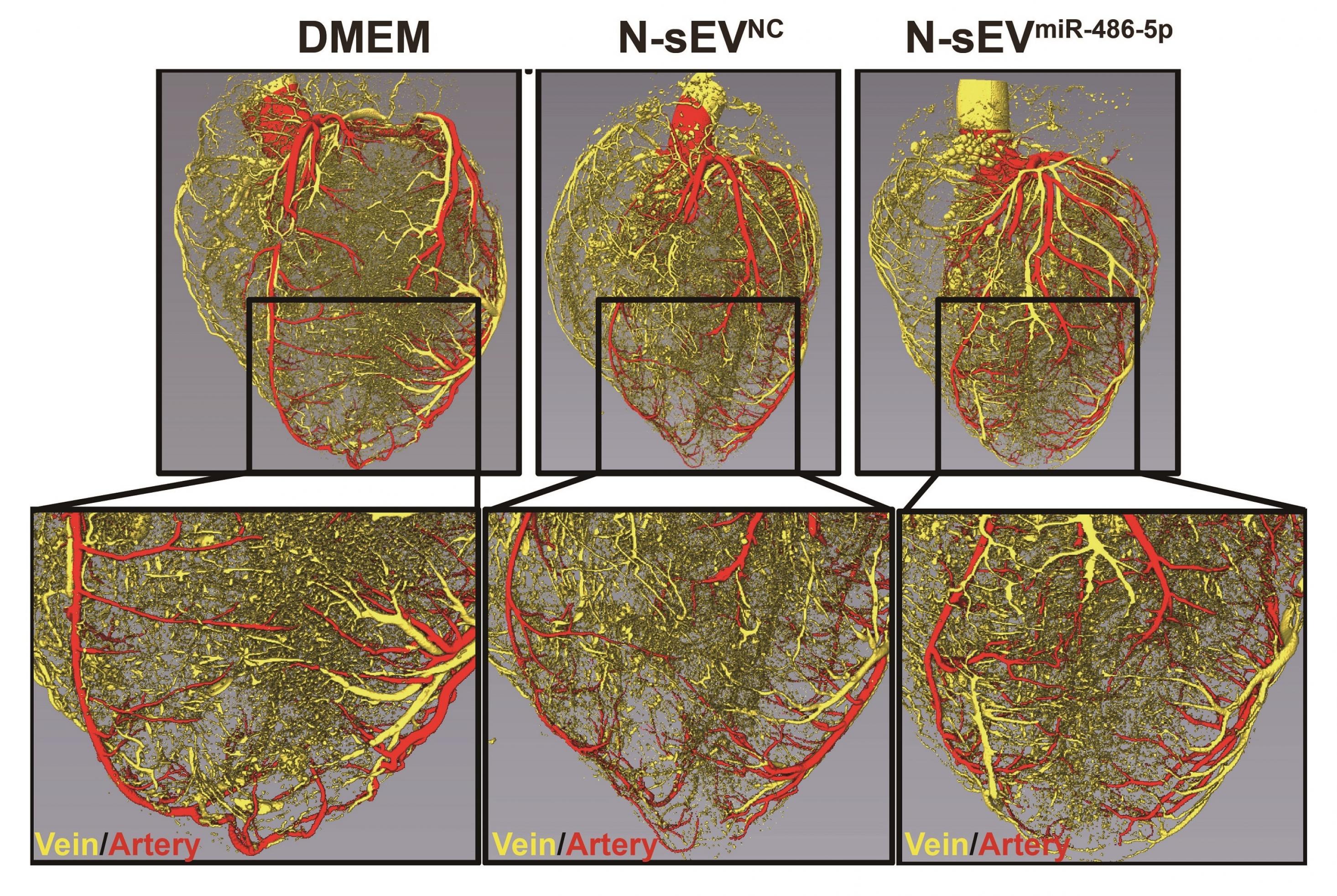
Nur Stammzellen, die schlecht mit Sauerstoff versorgt sind, erzeugen viel miR-486–5p und geben es ihren Vesikeln mit. Vermutlich wollen die Zellen ihre Sauerstoffversorgung ankurbeln, indem sie das Wachstum neuer Blutgefäße anregen. Vesikel von gewöhnlichen Stammzellen helfen den kranken Herzen deshalb auch nur dann, wenn die Forscher*innen sie zuvor künstlich mit der Mmp19 hemmenden Mikro-RNA angereichert haben.
Wichtig ist auch ein weiteres, wegen der geringen Zahl an Versuchstieren aber mit Vorsicht zu betrachtendes Resultat: Die neue Vesikel-Therapie löste bei den Makaken keine lebensbedrohlichen Herzrhythmusstörungen aus. Diese Komplikation war bei früheren Studien mit anderen Botenstoffen und Tieren häufig gewesen. „Unsere Studie unterstreicht die Schlüsselrolle extrazellulärer Stammzell-Vesikel mit miR-486–5p für das Wachstum neuer Herzkranzgefäße“, schreiben die Autor*innen. Daraus „könnte sogar ein therapeutischer Ansatz für eine Verbesserung der Reparatur des Herzens“ werden.
Ist Bewegung in der Schwangerschaft besonders wichtig?
Stoffwechselerkrankungen wie Typ-2-Diabetes und starkes Übergewicht nehmen in den meisten Ländern zu. Als mögliche Ursache gilt, dass sich Folgen übermäßiger und unausgewogener Ernährung ein Stück weit auf Nachkommen übertragen. Dieser Newsletter beschäftigt sich deshalb immer wieder mit der Weitergabe des elterlichen Risikos für Übergewicht an folgende Generationen, zuletzt im Beitrag Epigenetische Vererbung von Übergewicht in Ausgabe 33 (Erbe&Umwelt-Hintergrundartikel hier).
Zahlreiche Analysen bei Menschen und noch mehr Experimente mit Nagetieren zeigen, ein Teil der Risiken wird während der so genannten perinatalen Prägung weitergegeben, also durch epigenetische Anpassungen des Nachwuchses an Einflüsse aus dem Mutterleib und während der ersten Monate nach der Geburt. Vermutlich trägt zudem die epigenetische Vererbung bei, also die direkte Weitergabe von Umweltanpassungen der Eltern über Ei- und Samenzellen an Kinder und vielleicht sogar Enkel und Urenkel.

Jetzt haben Forscher*innen um Zhen Yan von der University of Virginia in Charlottesville, USA, diese Erkenntnisse in einer Studie mit Mäusen bestätigt und zudem einen Ansatz gefunden, wie man die fatale Kaskade mit einer vergleichsweise einfachen Maßnahme unterbrechen könnte: Hatten weibliche Mäuse ausschließlich während der Trächtigkeit viel Bewegung, war das Erkrankungsrisiko ihrer Jungtiere bis ins Erwachsenenalter normal – egal ob Mutter oder Vater fehlernährt und übergewichtig waren. Könnte man diese Resultate auf den Menschen übertragen, dürften zukünftige Präventionsmaßnahmen daran ansetzen, Bewegungsprogramme für Schwangere besonders attraktiv zu machen. Bislang wird Frauen vor allem empfohlen, ihr Gewicht zunächst zu normalisieren und erst dann schwanger zu werden. Auf das Übergewicht der Väter wird zudem kaum geachtet.
Die Forscher*innen zeigen zunächst, dass sich Bewegungsmangel und zu fettreiche Ernährung bei väterlichen und mütterlichen Elterntieren in der Epigenetik der Nachkommen niederschlägt und das Risiko für Stoffwechselkrankheiten erhöht. Die Übertragung des Risikos erfolgt aber auf verschiedenen Wegen, und es spielt eine gewisse Rolle, welches Geschlecht das übergewichtige Elterntier und das beobachtete Jungtier haben. Entscheidend ist jedoch, dass sich all diese Effekte alleine dadurch unterbinden lassen, dass sich das trächtige Muttertier auf einem Laufrad austoben kann. „Regelmäßige Bewegung ist möglicherweise die vielversprechendste Interventionsmaßnahme, um die Pandemie der chronischen Krankheiten zurückzudrängen“, sagt Zhen Yan, „denn sie kann den Teufelskreis der Krankheitsübertragung von Eltern auf ihre Kinder unterbrechen.“
Lesen Sie auch das intro des Newsletter Epigenetik 34.
Der Newsletter Epigenetikerscheint bis zu vier Mal pro Jahr und ist kostenfrei. Exklusive Hintergrund-Beiträge zu ausgewählten Themen erscheinen vorab bei Erbe&Umwelt. Aus der aktuellen Ausgabe sind es die Beiträge Wenn Schlafmangel auf die Gene schlägt, Anti-Aging Epigenetik: Zurück auf Jung und Systembiologie: Wie wir uns gesund rechnen.