- RiffReporter /
- Wissen /
Wie Brustkrebs-Patientinnen von einem neuen Gentest und Genomsequenzierung profitieren können
Wie Brustkrebs Erkrankte von der neuen Gen-Diagnostik profitieren können
Brust- und Eierstockkrebs entsteht oft durch Veränderungen in den Genen. Die Betroffenen erhalten nun Zugang zu besseren Untersuchungsmethoden. Eine DNA-Analyse des vollständigen Erbguts liefert wesentlich mehr Informationen als die bisherigen Gentests. Frauen mit erblichen Krebserkrankungen können dadurch sehr schnell eine spezielle Behandlung bekommen. Werden mehr Gendefekte entdeckt, ermöglicht das auch eine bessere Früherkennung
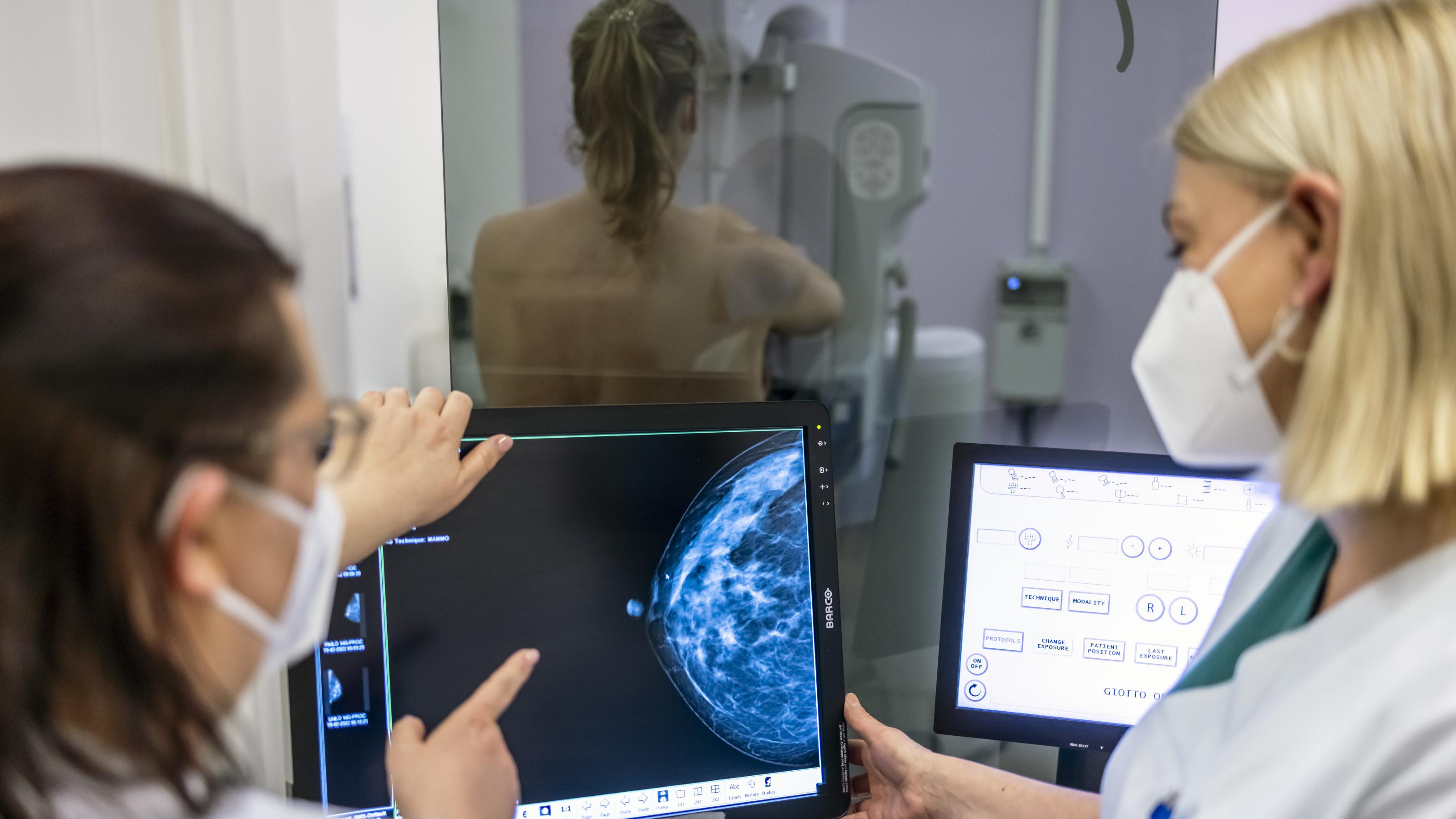
Im Juli hat das Modellvorhaben Genomsequenzierung begonnen. Ein sperriger Begriff für eine deutliche Verbesserung im Gesundheitswesen. Rita Schmutzler, Direktorin des Zentrums Familiärer Brust- und Eierstockkrebs der Universitätsklinik Köln, erklärt im Interview die Chancen, die für die Betroffenen aus der vollständigen Entschlüsselung der menschlichen DNA entstehen. Das Projekt könnte Tausenden Familien helfen, in denen sich vererbte Krebserkrankungen häufen. Sie erhalten eine bessere Diagnose, intensivere Früherkennung und vermutlich auch bessere Therapien.
Welche Rolle spielt das Genom bei Brust- und Eierstockkrebs?
Schmutzler: Wir haben einen Kriterienkatalog, wann ein Brustkrebs möglicherweise eine genetische Ursache hat. Ein Drittel aller erkrankten Frauen erfüllen die Kriterien, die auf eine erbliche Belastung hinweisen. Diesen Frauen bieten wir eine genetische Untersuchung an. Wir kennen zwar mittlerweile ein Dutzend Risikogene für den erblichen Brust- und Eierstockkrebs. Aber trotzdem finden wir nur bei einem Drittel der untersuchten Frauen genetische Veränderungen in den bekannten Risikogenen. Das trifft sogar für Hochrisiko-Familien zu. Deshalb sind wir sicher, dass es noch weitere genetische Veränderungen geben muss, die sich der derzeitigen Analyse mit Hilfe der einfachen Gen-Panels entziehen. Diese zu finden, darin liegt jetzt unsere große Chance.
Erhalten diese Frauen durch das Modellvorhaben eine bessere Diagnose?
Ja. Bei etwa der Hälfte dieser negativ getesteten Frauen gehen wir davon aus, dass der Krebs auf genetische Veränderungen zurückgeht, die wir bisher noch nicht entdeckt haben. Es gibt aber auch einen Teil von 20 bis 30 Prozent, der nicht genetisch bedingt, sondern dem Zufall geschuldet ist. Brustkrebs ist eine häufige Erkrankung, deshalb kann es auch sein, dass es in einer Familie zufällig mehrere Fälle gibt.
Hat die genetische Ursache einen Einfluss auf die Therapie?
Absolut, das ist schon heute so. Ich nenne als Beispiel die PARP-Inhibitoren, die seit einigen Jahren zugelassen sind. Diese ganz neue Substanzgruppe wurde erst entdeckt, nachdem man die Funktion der BRCA-Gene erforscht hatte. Durch bessere Kenntnisse über die Ursache der Erkrankung konnte man zielgerichtet forschen und neue Therapien entwickeln.
Die Mutationen in den BRCA-Genen sind schon lange bekannt.
Schon, aber vermutlich nicht alle. Da erwarten wir einen schnellen Nutzen von der Genomsequenzierung. Wir rechnen damit, auch in den bekannten Risikogenen weitere Veränderungen zu finden, die man mit der herkömmlichen Technik kaum erkennen konnte.
Wie schnell werden Frauen davon profitieren können?
Wenn wir in den bereits bekannten BRCA-Genen noch unbekannte Veränderungen finden, die Tumore auslösen, hätte das eine unmittelbare Konsequenz. Wir könnten sofort eine PARP-Inhibitor-Therapie anbieten. Das hängt natürlich auch vom Tumorstadium und den Zulassungskriterien ab. Aber für viele Frauen wäre das sofort eine Option. Werden dagegen ganz neue potentielle Risikogene entdeckt, muss man zunächst klären, ob die gefundenen Mutationen in diesen Genen wirklich kausal mit der Krankheit assoziiert sind, die Funktionsmechanismen erforschen und herausfinden, ob man intervenieren kann. Das wird natürlich dauern. Generell ist es für die Erkrankten hilfreich, wenn wir eine genetische Ursache finden, denn die Krankheitsgene bergen oft weitere Risiken in sich. Dann stellt sich die Frage nach Vorsorgemöglichkeiten. Gesunde Angehörige können wir präventiv testen, um eine Früherkennung anbieten zu können. Das ist schon heute unser tägliches Brot.
Es gibt also mehr als ein Dutzend Risikogene?
Wir rechnen damit, dass wir neue Mutationen in Genen identifizieren können, die wir bisher nicht kennen oder bei denen wir es nicht erwarten. Das wird aber Zeit in Anspruch nehmen. Wenn Sie das vollständige Genom untersuchen, finden sie bei jedem Menschen viele verschiedene Abweichungen. Es braucht zusätzlich Hinweise darauf, dass ein kausaler Zusammenhang mit Brustkrebs besteht. Gibt es mehrere Menschen mit der gleichen Veränderung in einem Gen, die tatsächlich an Brust- oder Eierstockkrebs erkrankt sind?
Wie findet man solche Zusammenhänge?
Es hilft es uns sehr, dass wir seit mehr als 20 Jahren in Deutschland für diese Erkrankung ein Konsortium als Zusammenschluss von mehr als 20 Unikliniken haben. Wir haben die weltweit größte Datenbank und Sammlung von Bioproben für Brust- und Eierstockkrebs. Darin sind knapp 150.000 Personen mit familiärer Belastung erfasst. Auf internationaler Ebene läuft daher kaum noch eine große Studie ohne uns. Mit Hilfe der Daten- und Biobank können wir die Verdachtsergebnisse aus der Sequenzierung weiter absichern.
Wie viele Menschen können teilnehmen?
Wir haben bisher nur Schätzungen, was auf uns zu kommt. Das Modellvorhaben läuft ja erst an. Der Spitzenverband der Krankenkassen kalkuliert gerade die Fallzahlen auf der Basis von Behandlungszahlen der antragstellenden Zentren aus den letzten Jahren. Es wird zunächst eine begrenzte Zahl an Untersuchungen geben. Spätestens nach zwei Jahren kommt aber die erste Evaluation. Dann wird geprüft, ob das Modellvorhaben funktioniert und genügend und die richtigen Patientinnen Zugang haben.
Wie gehen Sie vor?
Das Modellvorhaben ist zunächst den Hochrisikofamilien vorbehalten. Wenn vier oder fünf Familienmitglieder jung an Brust- oder Eierstockkrebs erkrankt sind, erschließt sich jedem, dass das kein Zufall sein kann. Hier steigen wir jetzt mit der vollständigen Genom-Sequenzierung ein.
Die Teilnahme ist freiwillig. Wie nehmen die Betroffenen das Angebot an?
Da hat sich in den vergangenen zwei Jahrzehnten unendlich viel getan. Mitte der 1990er Jahren stellten sich Menschen oft noch die Frage: Warte ich einfach ab, nehme ich mein Schicksal an? Das ist vorbei. Die überwältigende Mehrheit der Betroffenen will heute das genetische Risiko kennen. Wenn ich um das Risiko weiß, habe ich Optionen, das nutzen die Menschen. Wir haben bei Brust- und Eierstockkrebs eine gute Ausgangslage. Wir wissen, dass wir den Krebs so früh erkennen können, dass er deutlich besser heilbar ist. Das ist anders als bei genetischen Erkrankungen ohne Therapiemöglichkeit, bei denen Betroffene nur abwarten können, das die Krankheit ausbricht. Da fragt man sich, ob das Wissen wichtig für die eigene Lebensplanung ist oder ob ein positives Ergebnis zu sehr belastet.

Einige der betroffenen Frauen entscheiden sich für eine vorbeugende Operation. Bei neu erkannten Risikogenen muss das nicht unbedingt sinnvoll sein.
Solange wir keine sicheren Daten haben, dass eine Operation wirklich ratsam und effektiv ist, bieten wir sie nicht an. Es stehen ja Alternativen zur Verfügung, zum Beispiel eine intensivierte Früherkennung oder Nachsorge. Hinzu kommt: Wenn wir sofort operieren ohne ausreichende Erkenntnisse über die altersabhängigen Erkrankungsraten werden wir nie erfahren, wie hoch das Risiko wirklich ist, dass sich der Krebs entwickelt und wann der richtige Zeitpunkt für eine solche Operation ist. Wir wissen also nicht, ob das, was wir gemacht haben, richtig war. Das gilt es unbedingt zu vermeiden. Mit solchen Fragen beschäftigen wir uns im Konsortium seit Jahren und hier Klarheit zu gewinnen, ist eines unserer Hauptziele.
Bei erblichem Krebs kann die Veranlagung auf die Kinder übertragen werden. Das beunruhigt Familien.
Bei autosomal dominanten Genen besteht eine 50 Prozent-Wahrscheinlichkeit, dass die Klinder die Genveränderung ebenfalls tragen werden. Darüber machen sich Frauen und Ehepaare selbstverständlich Gedanken. Diesen Aspekt haben wir in den vergangenen Jahren zunehmend in den Fokus der Beratung genommen. Aber Krebs ist eine Erkrankung des Erwachsenenalters, deshalb müssen Menschen für eine Genomsequenzierung volljährig sein, Kinder sind ausgeschlossen. Es gibt Eltern aus schwer belasteten Familien mit vielfachen Todesfällen in jungen Jahren, die überlegen, ob sie eine Präimplantationsdiagnostik machen lassen wollen. Sie können einen entsprechenden Antrag stellen, der nach der geltenden Gesetzgebung von den eigens hierzu eingerichteten Ethikkommissionen entschieden wird.
Werden sich diese Fälle durch das Modellvorhaben häufen?
Da sehe ich keinen Zusammenhang. Die Sequenzierung ist ja nur eine andere Methodik, um eine unklare Situation aufzulösen, es entsteht dadurch aber keine prinzipiell neue Situation.
Erreichen Sie denn alle potenziell betroffenen Menschen?
Wir sind heute in der Situation, dass wir einen sozial ungerechten Zugang zur Gendiagnostik haben. Das haben uns soziologische Studien bestätigt. Zu uns kommen derzeit überwiegend Menschen, die gut informiert sind und von sich aus sagen, ich könnte von erblich bedingtem Krebs betroffen sein oder werden. Für bereits Erkrankte konnten wir die Situation schon maßgeblich verbessern. Die Unikliniken im Konsortium haben strukturierte Fortbildungsprogramme für Ärzte und Ärztinnen erstellt, die sehr gut angenommen werden. Ferner haben die Konsortialzentren ein Versorgungsnetz mit zertifizierten Brust- und gynäkologischen Zenten aufgebaut. Die Zertifizierung dieser Zentren durch die Deutsche Krebsgesellschaft ist an eine systematische Erfassung und Aufklärung von betroffenen Erkrankten hinsichtlich eines möglichen erblichen Risikos geknüpft. Das funktioniert mittlerweile hervorragend. Aber bei den Gesunden aus solchen Familien haben wir noch eine Bringschuld: Wir müssen insbesondere auch die weniger gut informierten Bürgerinnen und Bürger ansprechen. Das Ziel muss sein, dass jeder, jede einen Zugang zu dieser neuen Methode erhält. Dazu bedarf es viel mehr Informationen über genetische Erkrankungen, auch in einfacher Sprache und in Videos. Auch das gehört zum Modellvorhaben.
Wie komme ich in das Modellvorhaben rein?
Erkrankte idealerweise durch den behandelnden Arzt oder die Ärztin. Deshalb werden auch die ÄrztInnen im Rahmen des Modellvorhabens über die neuen Diagnostikmethoden informiert. Wir haben aber auch spezialisierte Zentren für onkologische und seltene Erkrankungen. Dort besprechen Experten in interdisziplinären Boards die Fälle. Sie sind die Eintrittspforte zum Modellvorhaben. Die PatientInnen müssen dorthin gelangen. Das läuft schon, dank der aufgebauten gut vernetzten Strukturen.
Das Modellvorhaben ist auf fünf Jahre angesetzt. Wird es danach fortgeführt werden?
Die Befristung ist richtig. Bei onkologischen Erkrankungen müssen wir noch belegen, dass wir genetische Veränderungen finden, die Auswirkungen auf die Therapie oder die Prävention haben, von denen die Patienten am Ende profitieren. Das ist aus meiner Sicht noch keineswegs gesichert, aber natürlich unser Ziel.
Für weitere Informationen zum Modellvorhaben Genomsequenzierung wurde eine Webseite eingerichtet.
Weitere Texte zum Themenfeld menschliches Genom:
In Deutschland leben mehr als vier Millionen Menschen mit seltenen Erkrankungen. Häufig ist die Ursache ihrer Krankheit nicht bekannt. Viele Betroffene berichten von einer endlosen Reise von Ärztin zu Arzt. Das soll sich nun ändern: Im Juli startete das Modellvorhaben Genomsequenzierung, das die Analyse des eigenen Erbguts erleichtert.
Unabhängig vom Modellvorhaben gibt es Bestrebungen, in der Zukunft das Erbgut von Neugeborenen nach Auffälligkeiten zu untersuchen, um Entwicklungsstörungen von Kindern früher erkennen zu können.
Im Jahr 2019 entstand ein Alltags-Szenario zur Bedeutung der Genomdiagnostik für den Alltag der Betroffenen.
Der Deutsche Ethikrat hat sich mit der Frage beschäftigt, ob das Genom von Menschen verändert werden darf.